Select item 2937602915. Hijacking of the Host Ubiquitin Network by Legionella pneumophila. Qiu J, Luo ZQ. Front Cell Infect Microbiol. 2017 Dec 5;7:487. doi: 10.3389/fcimb.2017.00487. eCollection 2017. Review. PMID: 29376029 Free PMC Article Similar articles
Suomennosta tiivistelmästä
Monissa eukaryoottisissa soluprosesseissa on ubikitinaatio säätelylle kriittinen. Näitä soluprosesseija ovat proteiinihomeostaasi, solusyklin edistyminen, immuunivaste, DNA-korjaus ja rakkuloitten kuljetusjärjestelmä. Ubikitinoiminen johtaa usein proteiinin vakauden, solusijainnin tai proteiinien välisen interaktion muuntumisiin. Ottaen huomioon ubikitinaation tärkeyden isäntäsolun immuniteetin säätelyssä niin ei ole mikään ihme, että monet infekioivat agenssit ovat kehittäneet strategioita, jotka interferoivat ubikitinaatioverkostoon sofistisin mekanismein kuten funktionaalisella samankaltaisuudella.
Fakultatiivisesti intrasellulaarinen patogeeni Legionella pneumophila aiheuttaa legionelloositautia.
Makrofagit fagosytoivat Legionella pneumophilaa ja se kykenee replikoitumaan eräänlaisessa sopukassa, jota sanotaann Legionellaa sisältäväksi vakuoliksi (LCV) .
LCV vakuolin biogeneesi on riippuvainen Dot/Icm tyyppi IV sekretiojärjestelmästä, joka vapauttaa yli 330 effektoriproteiinia isäntäsolun sytosoliin. L. pneumophilabakteerin optimaalinen solunsisäinen replikoituminen vaatii isäntäsolun ubikitiini-proteosomijärjestelmää.
Lisäksi bakteerifagosomin kalvot ovat rikastuneet ubikitinoiduilla proteiineilla sillä tavalla, joka vaatii Dot/Icm-tyyppi IV sekreetiosysteemiä, mikä viittaa siihen, että effektorit ovat osallistuneet isäntäsolun ubikitinaatiokoneiston manipuloimiseen.
Tässä artikkelissa tekijät tekevät yhteenvetoa käsityksestään niistä mekanismeista, joita L. pneumophilan effektoriproteiinit käyttävät hyväkseen kaapatakseen isäntäsolun ubikitinaatiotien. Avainsanoja: bakteerivirulenssi, solusignalointi, posttranslationaalinen modifiointi, tyyppi IV eritys.
- Abstract
- Protein ubiquitination is critical for regulation of numerous eukaryotic cellular processes such as protein homeostasis, cell cycle progression, immune response, DNA repair, and vesicular trafficking. Ubiquitination often leads to the alteration of protein stability, subcellular localization, or interaction with other proteins. Given the importance of ubiquitination in the regulation of host immunity, it is not surprising that many infectious agents have evolved strategies to interfere with the ubiquitination network with sophisticated mechanisms such as functional mimicry. The facultative intracellular pathogen Legionella pneumophila is the causative agent of Legionnaires' disease. L. pneumophila is phagocytosed by macrophages and is able to replicate within a niche called Legionella-containing vacuole (LCV). The biogenesis of LCV is dependent upon the Dot/Icm type IV secretion system which delivers more than 330 effector proteins into host cytosol. The optimal intracellular replication of L. pneumophila requires the host ubiquitin-proteasome system. Furthermore, membranes of the bacterial phagosome are enriched with ubiquitinated proteins in a way that requires its Dot/Icm type IV secretion system, suggesting the involvement of effectors in the manipulation of the host ubiquitination machinery. Here we summarize recent advances in our understanding of mechanisms exploited by L. pneumophila effector proteins to hijack the host ubiquitination pathway. KEYWORDS: bacterial virulence; cell signaling; effectors; posttranslational modification; type IV secretion PMID: 29376029 PMCID: PMC5770618 DOI: 10.3389/fcimb.2017.00487
Free PMC Article
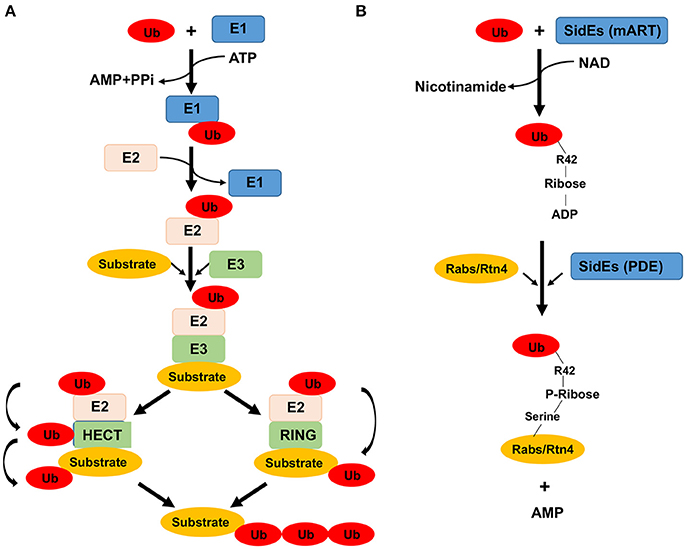
1)Kanoninen ubikitiiniverkostomekanismi , jossa toimi ubikitiini ja E1, E2, ja E3 entsyymit
1)Kanoninen ubikitiiniverkostomekanismi , jossa toimi ubikitiini ja E1, E2, ja E3 entsyymit
E1 entsyymejä on kaksi geeniä. Ne ovat ubikitiinin aktivoijia.
E2 entsyymejä , ubikitiinia konjugoiva entsyymi, näitä geenejä on useita kymmeniä.
E3 entsyymeitä on ihmisgenomissa yli 1000 geeniä. Niitä on kolme pääryhmää: HECT, RING ja RING-IBR-RING.
Monoubikitinaatio ja multimonoubikitinaatio säätelevät subsellulaarisia proteiinin lokalisoitumisia, endosytoosia ja ubikitiiniä sitovien proteiinien rekrytoimista.
Polyubikitiiniketjun muodostuminen voi tapahtua yhdessä seitsemästä lysiinitähteestä K6, K11, K27, K29, K33, K48 ja K63.
Jos polyubikitinaatio tapahtuu K48 lysiiniin, proteiini on merkkautunut hajoitustielle silppuroitavaksi.
K63 ubikitiinimerkkaus kontrolloi solusignalointia, DNA-korjautumista, endosytoosia, rakkulakuljetusta, immuniteettia ja solusyklin progredioitumista.
2) Deubikitinaasit (DUB) uudelleenkierrättävät ubikitiinia irrottaen sen proteiinista ja palauttaen samalla proteiinin ennalleen. (DUB- entsyymi, joita on viisi ryhmää (UCH, UCP, MJD, OTU, JAMM). Deubikitinaasit pilkkovat isopeptidisidoksen ubikitiinin ja modifioidun proteiinin välistä.
- Figure 1. Enzymes and chemical reactions involved in ubiquitination catalyzed by the canonical mechanism and by members of the SidE family proteins. (A) In the canonical mechanism, a ubiquitin molecule is activated by E1 at the expense of an ATP. The activated ubiquitin is first linked to E1 via a labile thioester bond prior to being transferred to the E2 conjugation enzyme, also linked by a thioester bond. The final step of the reaction differs greatly among different groups of E3 enzymes which dictate substrate specificity. For members of the HECT family of E3 enzymes (left), a reaction intermediate is formed, again by the formation of a thiolester bond between ubiquitin and E3, from where it is finally linked to lysine residues of the substrate. For other groups of E3 enzymes such as the RING family, the ubiquitin moiety is directly transferred to the substrate without the formation of an intermediate.
Artikkeliin liittyy kuva ( B-kohta ) selityksineen.
Ei tiedetä, miten legionellan SidE (mART motiivi) pystyy tunnistamaan ubikitiinin, mutta niin se tekee. Reaktiota katalysoi SidE perheen proteiinii ja se aloittaa ubikitiinin aktivaatiosta tekemällä ADP-ribosylaation arginiiniin R42 ja tuottaaa täten reaktiovälituotetta ADRP-Ub, ADP-ribosyloituneen ubikitiinin, ja samalla vapautuu nikotinamidia reaktioon kuluneesta NAD- molekyylistä.
Seuraavassa reaktiossa ADPR-Ub pilkkoutuu fosfodiesteraasilla (PDE), jota on myös SidE(PDE) effektoriproteiinissa ja nyt seuraa fosforibosyloituneen ubikitiinin liittyminen seriinitähteisiin substraatissa ja samalla vapautuu AMP. Myöskään tätä SidE (PDE)-domaanin avulla tapahtuvaa susbtraatin tunnistusmekanismia ei tarkemmin tiedetä.
- (B) The reaction catalyzed by the SidE family begins with ubiquitin activation by ADP-ribosylation at Arg42 to produce the reaction intermediate ADP-ribosylated ubiquitin (ADPR-Ub), a nicotinamide moiety is released in this step of the reaction. In the second reaction, ADPR-Ub is cleaved by a phosphodiesterase (PDE) activity also embedded in these proteins, resulting in the attachment of phosphoribosylated ubiquitin to serine residues of the substrate and the release of AMP. How ubiquitin is recognized by the mART motif is unknown, nor is the mechanism of substrate recognition presumably by the PDE domain.
Inga kommentarer:
Skicka en kommentar